Voy a intentar en este artículo compartir con ustedes qué son las enzimas, esos maravillosos catalizadores biológicos, sin recurrir a explicaciones demasiado científicas. Para entender el funcionamiento de las enzimas, hay que verlas como trabajadores especializados del cuerpo humano, trabajadores que hemos decidido en Biovie llamar "auxiliares metabólicos", ya que las enzimas no aportan ningún nutriente (no son suplementos alimenticios); nos ayudan a optimizar las funciones del cuerpo, ya sean metabólicas o digestivas, a través de un gran número de reacciones bioquímicas.
¿Qué son exactamente las enzimas ?
En los organismos vivos, las enzimas son proteínas que aceleran un gran número de tipos de reacciones bioquímicas y de reacciones químicas necesarias para la vida. Imaginen una unidad de producción donde cada máquina (enzima) está diseñada para realizar una tarea específica de manera rápida y eficiente. Estas máquinas (enzimas) son cruciales para descomponer los macronutrientes en unidades más pequeñas asimilables, transformar los nutrientes en energía, reparar nuestras células y órganos, y muchas otras funciones vitales.
Cada enzima interviene en una reacción bioquímica muy precisa., es única y solo funciona con un tipo particular de "pieza", es decir, una molécula de sustrato con la cual presenta una complementariedad de forma, como dos piezas de un rompecabezas en 3D para su propia reacción enzimática. Se habla de especificidad de sustrato. La enzima se adhiere a esta pieza y la transforma, permitiendo así que reacciones complejas ocurran rápidamente y sin desperdiciar energía. Es un poco como una llave que abre una cerradura específica: la enzima (llave) solo funciona en su sustrato (cerradura).. Esto es lo que se llama actividad enzimática, y es lo que caracteriza, además, la diferencia entre lo vivo y lo inerte.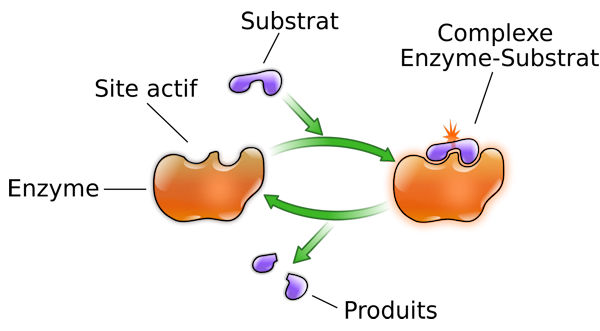
(fuente: Wikipedia)
Las enzimas también son reutilizables y reciclables., no se "desgastan" por su uso. De hecho, esa es la definición misma de una reacción catalítica: la sustancia responsable de la reacción se encuentra intacta al final de la reacción. Después de transformar un sustrato, están libres para comenzar de nuevo con otro. Gracias a esto, incluso en pequeñas cantidades, pueden realizar muchas reacciones en poco tiempo, y cuando están en su entorno de funcionamiento óptimo, especialmente a la temperatura corporal, son muy rápidas.
En cuanto a la salud, las enzimas son esenciales. Participan en todo, desde la digestión de los alimentos hasta la reparación del ADN. Cuando no funcionan correctamente, pueden causar problemas serios, como enfermedades genéticas, trastornos autoinmunes e incluso algunos tipos de cáncer.
Finalmente, es importante saber que las enzimas que producimos y las que consumimos en los alimentos desempeñan roles diferentes, pero todas son importantes para un metabolismo saludable.
Para entender mejor, se puede comparar a las enzimas con asistentes personales muy eficientes en el cuerpo. Ellas se encargan de todo, desde la conversión de los alimentos en energía utilizable hasta la gestión de los desechos celulares. Es como si cada proceso metabólico tuviera su propio asistente dedicado, garantizando que todo funcione sin problemas y a un ritmo constante.
El aspecto fascinante de las enzimas es su precisión extrema. No se limitan a trabajar en cualquier reacción química; apuntan a reacciones específicas. Esta especificidad evita el caos metabólico al asegurar que las reacciones correctas ocurran en el lugar y momento adecuados.
Las enzimas también desempeñan un papel clave en nuestra salud al regular las vías metabólicas. Actúan como reguladores de velocidad, acelerando o ralentizando las reacciones según las necesidades de nuestro cuerpo. Cuando este sistema se ve perturbado, pueden surgir desequilibrios que provocan problemas de salud.
Por ejemplo, si una enzima clave es deficiente o está ausente debido a una mutación genética, esto puede provocar una enfermedad metabólica y problemas en cascada. Por el contrario, si una enzima es demasiado activa, los procesos se descontrolan literalmente y esto puede conducir a enfermedades autoinmunes o incluso a ciertos tipos de cáncer.
En resumen, las enzimas son actores indispensables en el complejo teatro de nuestro metabolismo. Su papel en el mantenimiento de nuestra salud es tan crucial como invisible, orquestando discretamente una multitud de procesos vitales que nos permiten vivir, crecer y mantenernos saludables.
Roles de las enzimas en el organismo
Las enzimas, estos auxiliares metabólicos, desempeñan un papel indispensable en nuestro cuerpo, como hemos visto. Aceleran y facilitan numerosas reacciones bioquímicas esenciales para nuestra vida cotidiana. Aquí hay algunos ejemplos concretos de su acción:
Glucólisis: Esta reacción bioquímica es un poco como descomponer una pieza compleja (el azúcar, la glucosa) para extraer energía (ATP) y otros componentes útiles. Varias enzimas colaboran aquí, y si no funcionan bien, esto puede provocar problemas como la disminución del nivel de azúcar en la sangre, la debilidad muscular y otros trastornos metabólicos.
Digestión: Imaginen herramientas especializadas (enzimas digestivas) que, al cortar los enlaces químicos, reducen los alimentos en pequeñas moléculas (nutrientes) que nuestro cuerpo puede utilizar. Estas reacciones comienzan desde el inicio del tubo digestivo, gracias a las enzimas producidas por las glándulas salivales, por ejemplo, las proteínas se cortan en aminoácidos. Si estas enzimas-herramientas son defectuosas, la digestión se ve comprometida, lo que puede llevar a problemas de malnutrición, dolores abdominales, hinchazón y diarrea, y sobre todo a una mala asimilación de lo que comemos, independientemente de la calidad de estos alimentos.
Reparación del ADN: Las enzimas de reparación del ADN actúan como verdaderos técnicos de mantenimiento, detectando y reparando los diferentes daños observados en nuestro material genético. Si no funcionan correctamente, esto puede provocar mutaciones genéticas, aumentar el riesgo de cáncer y acelerar el envejecimiento.
Ciclo de la urea: Este proceso convierte el amoníaco tóxico en una sustancia menos peligrosa (urea) que nuestro cuerpo puede eliminar fácilmente a través de los riñones. Las enzimas involucradas en este proceso son cruciales; su disfunción puede provocar una acumulación de amoníaco en la sangre, dañando gravemente el cerebro y otros órganos.
Síntesis de la hemoglobina: La hemoglobina, transportada por nuestros glóbulos rojos, es esencial para llevar el oxígeno a todo el cuerpo. Si la enzima responsable de su producción es deficiente, esto puede causar anemia, lo que resulta en fatiga, debilidad, dificultad para respirar y palidez.
En resumen, las enzimas son actores clave en procesos vitales, ya se trate de reacciones anabólicas (construcción de moléculas) o de reacciones catabólicas (descomposición de moléculas)., y su buen funcionamiento es esencial para nuestra salud y bienestar.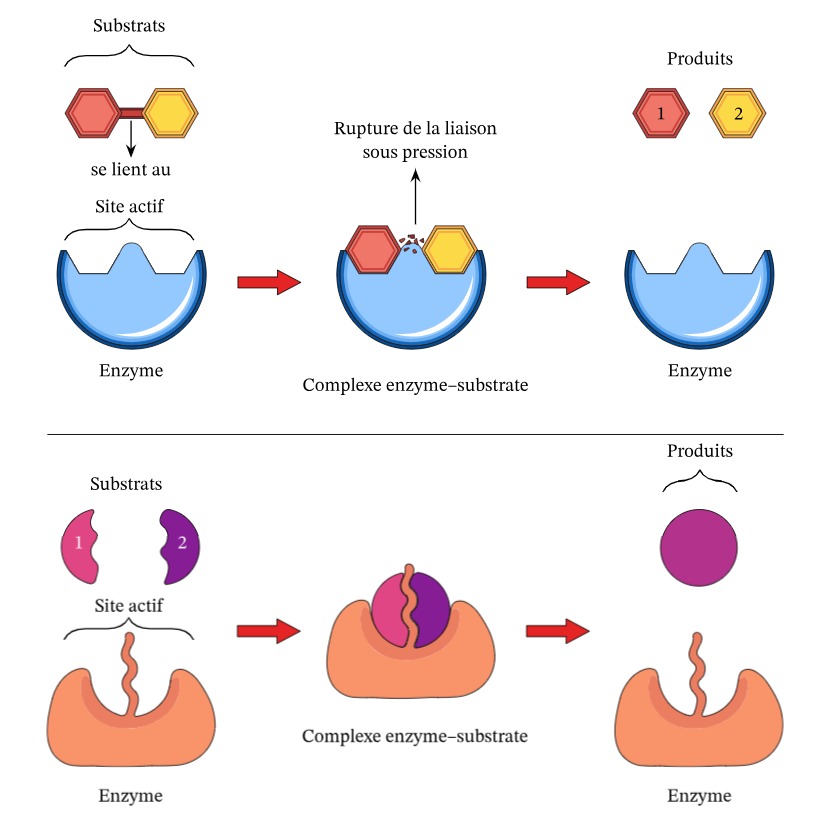
Enzimas y temperatura
A alta temperatura, los enlaces internos de las enzimas se rompen y la enzima pierde su forma. (se llama su estructura tridimensional); su actividad cesa, las células vivas se convierten en células muertas. A esta temperatura, un alimento pierde sus enzimas alimentarias intrínsecas. Esto explica por qué los alimentos cocidos más allá de cierta temperatura son menos digestibles que los alimentos crudos, ya que los alimentos cocidos ya no poseen estas enzimas internas, y el cuerpo humano, en lugar de beneficiarse de ellas, debe fabricar nuevas para digerir los alimentos correctamente, lo que tiene un costo biológico, por supuesto. En otras palabras, las enzimas digestivas son destruidas por el calor de la cocción y nuestro organismo ya no puede beneficiarse de ellas, y las reacciones enzimáticas ya no tienen lugar. En cambio, a temperaturas inferiores a la temperatura del cuerpo, las enzimas permanecen activas.
Las enzimas son sensibles al calor, un poco como esculturas de hielo complejas y delicadas. Cada enzima tiene una forma tridimensional específica, mantenida unida por enlaces frágiles. Esta forma es crucial para su funcionamiento, ya que les permite unirse a sus sustratos y acelerar las reacciones químicas. Como una pieza de rompecabezas sensible al calor, que se deformaría de manera irreversible al fundirse por encima de su temperatura de fusión:
Influencia de la Temperatura: Cada enzima tiene una "temperatura ideal" en la que funciona mejor, a menudo cercana a la temperatura corporal del organismo del que proviene. Por ejemplo, las enzimas humanas son óptimas alrededor de 37°C. A esta temperatura, son lo suficientemente flexibles para realizar sus tareas de manera eficiente.
Efecto de la Baja de Temperatura: Cuando hace más frío, las enzimas se ralentizan. Se mueven menos e interactúan menos con sus sustratos, lo que disminuye la velocidad de las reacciones que catalizan. Afortunadamente, las bajas temperaturas generalmente no destruyen las enzimas de manera permanente.
Efecto del Aumento de la Temperatura: Por otro lado, cuando la temperatura aumenta, las enzimas se activan primero y funcionan más rápidamente, pero si la temperatura sube demasiado, comienzan a deformarse y pierden su capacidad para funcionar. Esta pérdida de estructura (desnaturalización) es irreversible. ; una vez destruida, la enzima no puede repararse. Esta es la razón principal por la que recomendamos una alimentación lo menos cocida posible, para preservar el capital enzimático de nuestros alimentos.
En nuestros alimentos, las enzimas casi siempre se destruyen durante la cocción o el procesamiento industrial, ya que estos procesos utilizan temperaturas muy por encima de su umbral de tolerancia al calor. Esta temperatura varía en función del tipo de enzima, por ejemplo, la pectinasa se desactiva alrededor de 50°C, la amilasa hacia 70°C, la proteasa y la catalasa hacia 60°C.
Finalmente, un ligero aumento de la temperatura corporal, como durante una fiebre, puede impulsar nuestro sistema inmunológico. Este calor adicional pero no destructivo acelera las enzimas involucradas en la defensa de nuestro cuerpo, ayudando así a combatir las infecciones de manera más eficiente y rápida. Algunas enzimas clave del sistema inmunológico, como los interferones, pueden incluso ser más activas a temperaturas ligeramente más altas de lo normal.
A continuación: hablaremos en dos artículos más sobre dos categorías específicas de enzimas; las enzimas digestivas y las enzimas metabólicas.
Fuentes:
Could you please provide the full text you would like translated? "Berg" alone does not provide enough context for an accurate translation., J.M., Sure, please provide the text you would like me to translate from French to Spanish., J.L., Gatto, G.J., & Stryer, L. (2015). Bioquímica (8ª ed.). Nueva York: W.H. Freeman y Compañía.
It seems like the text you provided is incomplete or may be a reference to authors or a book. Could you please provide more context or the complete text so I can assist you better with the translation?, J.G., & Pratt, C.W. (2013). Fundamentos de Bioquímica: La Vida a Nivel Molecular (4ª ed.). Hoboken, NJ: John Wiley & Sons.
Could you please provide the text you would like translated from French to Spanish?, D.L., & Cox, M.M. (2017). Principios de Bioquímica de Lehninger (7ª ed.). Nueva York: W.H. Freeman y Compañía.
Sharma, H. K., Prasad, K., & Dinesh, M. R. (2011). Bioquímica y Biotecnología de las Pectinasas: Una Revisión. International Journal of Food and Fermentation Technology, 1(1), 1-15.
P. M. Nielsen (1994) Funcionalidad de las enzimas exógenas en sistemas de masa. En: Journal of Cereal Science, 20(1): 47-57.
V. C. Pandey et al. (2000) Tecnología enzimática en el procesamiento de alimentos. En: Journal of Food Science and Technology, 37(2): 123-135.
A. K. Mondal et al. (2012) Actividades de la Catalasa, Estabilidad y Cinética: Un Estudio Comparativo. En: Journal of Microbiology, Biotechnology and Food Sciences, 1(5): 1205-1214.
Berg, J. M., Tymoczko, J. L., & Stryer, L. (2002). Bioquímica (5ª ed.). Nueva York: W.H. Freeman. (El capítulo 8, "Enzimas: Conceptos Básicos y Cinética")
Isaacs, A., Lindenmann, J., & Valentine, R. C. (1957). Interferencia viral. II. Algunas propiedades del interferón. Proceedings of the Royal Society of London. Series B - Biological Sciences, 147(927), 268–273. doi: 10.1098/rspb.1957.0048.








